La leucemia mielomonocítica juvenil
La leucemia es el cáncer más frecuente en niños. Afecta a más de 350 peques al año en nuestro país, un tercio son menores de 4 años. La leucemia representa el 30% de todos los cánceres pediátricos, siendo la leucemia linfoblástica aguda B, la forma más común en niños (80% de los casos). La leucemia mieloide aguda afecta aproximadamente a un 20% de los pacientes de leucemia en edad pediátrica, especialmente antes de los 2 años. La leucemia mielomonocítica juvenil es una forma rara y grave de leucemia que afecta a menos de 10 niños al año en nuestro país.
La información proporcionada en www.fcarreras.org sirve para apoyar, no reemplazar, la relación que existe entre los pacientes/visitantes de este sitio web y su médico.
Información proporcionada por la Dra. Laura Belver, investigadora en leucemia mielomonocítica juvenil del Instituto de Investigación contra la Leucemia Josep Carreras
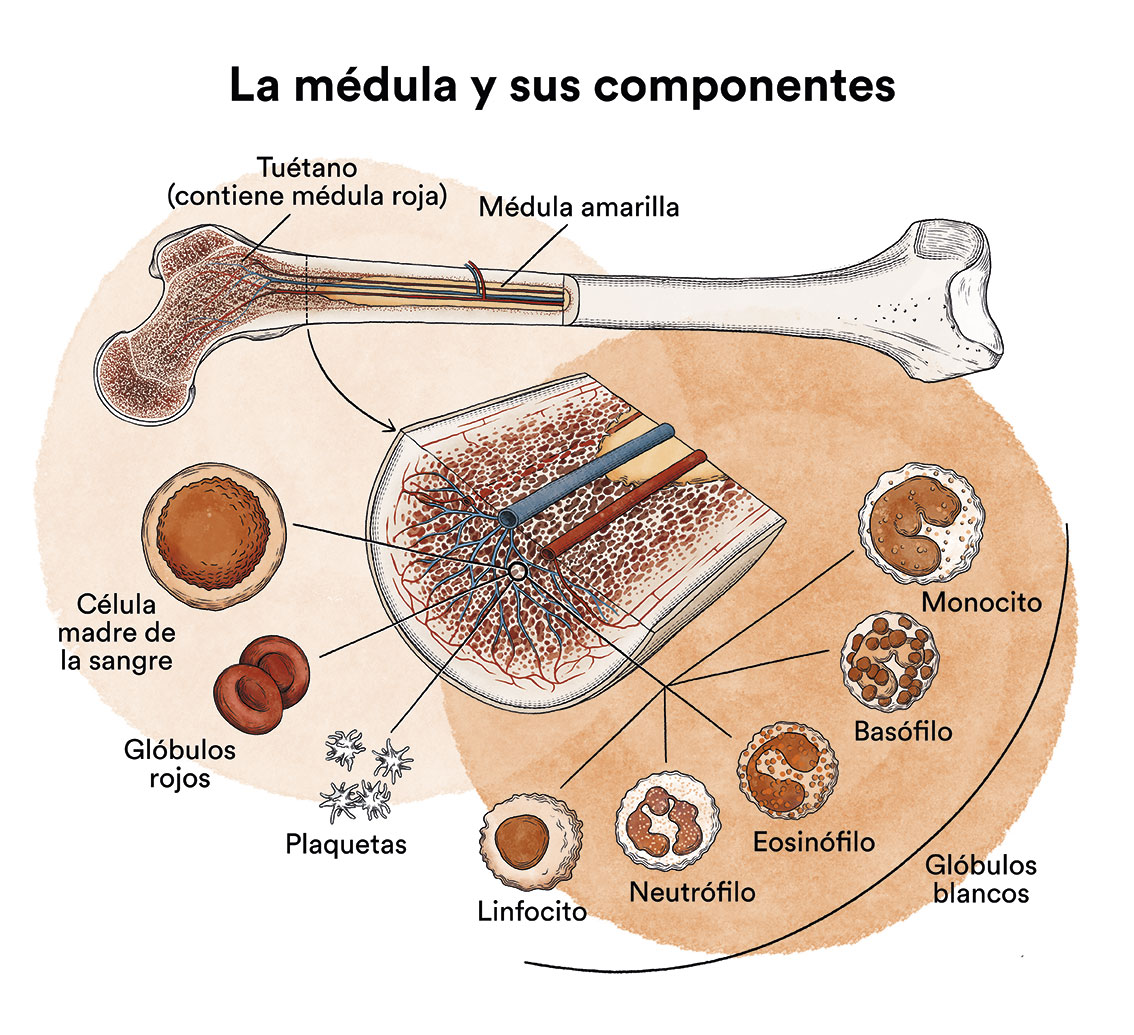
¿Qué es la leucemia, la médula ósea y cuáles son los tipos de células sanguíneas?
La leucemia es un tipo de cáncer de las células de la sangre y de la médula ósea. Ver apartado Leucemia, médula ósea y células sanguíneas.
¿Qué es la leucemia mielomonocítica juvenil?
 La leucemia mielomonocítica juvenil (LMMJ) ocurre cuando las células madre o células progenitoras de la médula ósea , responsables de la generación de todas las células sanguíneas, se comportan de una manera anormal, proliferando de forma descontrolada y produciendo grandes números de monocitos en la sangre que se infiltran en distintos órganos del paciente.
La leucemia mielomonocítica juvenil (LMMJ) ocurre cuando las células madre o células progenitoras de la médula ósea , responsables de la generación de todas las células sanguíneas, se comportan de una manera anormal, proliferando de forma descontrolada y produciendo grandes números de monocitos en la sangre que se infiltran en distintos órganos del paciente.
La leucemia mielomonocítica juvenil es un tipo de leucemia muy raro, que presenta una incidencia de tan solo 1,2 casos por cada millón de niños menores de 14 años, siendo más frecuente en varones (2 de cada 3 pacientes). Cada año se diagnostican en España entre 5 y 10 casos de LMMJ, en su gran mayoría en niños y niñas menores de 2 años, aunque también puede presentarse en edades más avanzadas, especialmente en pacientes que padecen neurofibromatosis tipo 1. Aproximadamente el 10 % de los casos de LMMJ ocurren en bebés menores de 3 meses.
¿Cuáles son las causas de la leucemia mielomonocítica juvenil?
 Las causas específicas que originan la leucemia mielomonocítica juvenil no se conocen. Sin embargo, se han identificado cinco genes que presentan mutaciones en las células de la médula ósea del 90% de los pacientes de LMMJ. Estas mutaciones se consideran los desencadenantes de la enfermedad. En el 10% restante de los pacientes la mutación genética que actúa como promotora de la leucemia aún se desconoce.
Las causas específicas que originan la leucemia mielomonocítica juvenil no se conocen. Sin embargo, se han identificado cinco genes que presentan mutaciones en las células de la médula ósea del 90% de los pacientes de LMMJ. Estas mutaciones se consideran los desencadenantes de la enfermedad. En el 10% restante de los pacientes la mutación genética que actúa como promotora de la leucemia aún se desconoce.
Algunas enfermedades del desarrollo, como la neurofibromatosis tipo 1 y el síndrome CBL, pueden hacer que un niño sea más proclive a desarrollar una leucemia mielomonocítica juvenil.
La leucemia, como otros tipos de cáncer, no es contagiosa. Ver apartado Leucemia, médula ósea y células sanguíneas.
¿Cómo se clasifica la leucemia mielomonocítica juvenil?
La leucemia mielomonocítica juvenil es muy heterogénea y ha sido siempre difícil de clasificar. A lo largo del tiempo se la ha denominado leucemia mieloide crónica juvenil, leucemia mielomonocítica crónica infantil o síndrome de monosomía 7 infantil. Ver clasificación LMMJ.
¿Cuáles son los síntomas de la leucemia mielomonocítica juvenil?
La presentación clínica de la leucemia mielomonocítica juvenil es variable y, en general, los síntomas en el diagnóstico se deben a la infiltración de las células leucémicas en la médula ósea y otros órganos, dificultando su correcto funcionamiento.
Esto puede ocasionar:
- Cansancio, debilidad, mareos y palidez, como consecuencia del bajo número de glóbulos rojos en la sangre (anemia)
- Aparición de hematomas y pequeñas manchas rosadas en la piel (petequias), así como otros tipos sangrados como hemorragias nasales o de encías, debido al bajo número de plaquetas en la sangre.
- Fiebre e infecciones que no evolucionan bien (bronquitis, amigdalitis…), por la generación deficiente de las células del sistema inmunológico.
- En algunas ocasiones ocurre la inflamación dolorosa de los ganglios linfáticos, el hígado o el bazo, debido a la acumulación de células leucémicas.
- Dolor o sensación de llenura en las costillas
- Tos seca
- Pérdida de apetito e insuficiencias del crecimiento

Al inicio de la enfermedad, todos estos síntomas pueden confundidos con los de una infección vírica, por lo que conseguir el diagnóstico final del paciente puede prolongarse durante varias semanas. Sin embargo, en general esto no afecta las opciones de curación del niño o niña.
¿Cómo se diagnostica la leucemia mielomonocítica juvenil?
Además de los estudios básicos en sangre y medula ósea comunes para todo tipo de leucemia (morfología y recuento celular, inmunofenotipo), los análisis citogenéticos (para detectar anomalías cromosómicas) y moleculares (para detectar mutaciones) son fundamentales para tipificar y clasificar la enfermedad. Determinadas alteraciones genéticas pueden predecir la agresividad de la enfermedad y el riesgo de recaída del paciente. Todos los pacientes con sospecha de leucemia mielomonocítica juvenil se someten a un análisis genético en el que se comparan sus células tumorales con sus células normales. En más del 90% de los pacientes con leucemia mielomonocítica juvenil se detectan mutaciones en uno de estos cinco: PTPN11, KRAS, NRAS, NF1 o CBL. Todos estos genes pertenecen a la llamada vía de señalización RAS, que controla el crecimiento y la división celular. Las mutaciones que se encuentran en la leucemia mielomonocítica juvenil producen la hiperactivación de esta vía, lo que hace que las células tumorales crezcan de manera descontrolada.
¿Cuál es el tratamiento de la leucemia mielomonocítica juvenil?
Actualmente no existe un tratamiento específico para tratar la leucemia mielomonocítica juvenil. El único tratamiento que ha demostrado poder curativo es el trasplante de progenitores hematopoyéticos (trasplante de médula ósea) de un donante HLA compatible. A pesar de ello, es una terapia no exenta de riesgos y complicaciones y, aproximadamente un 30% de los niños recaen después del trasplante.
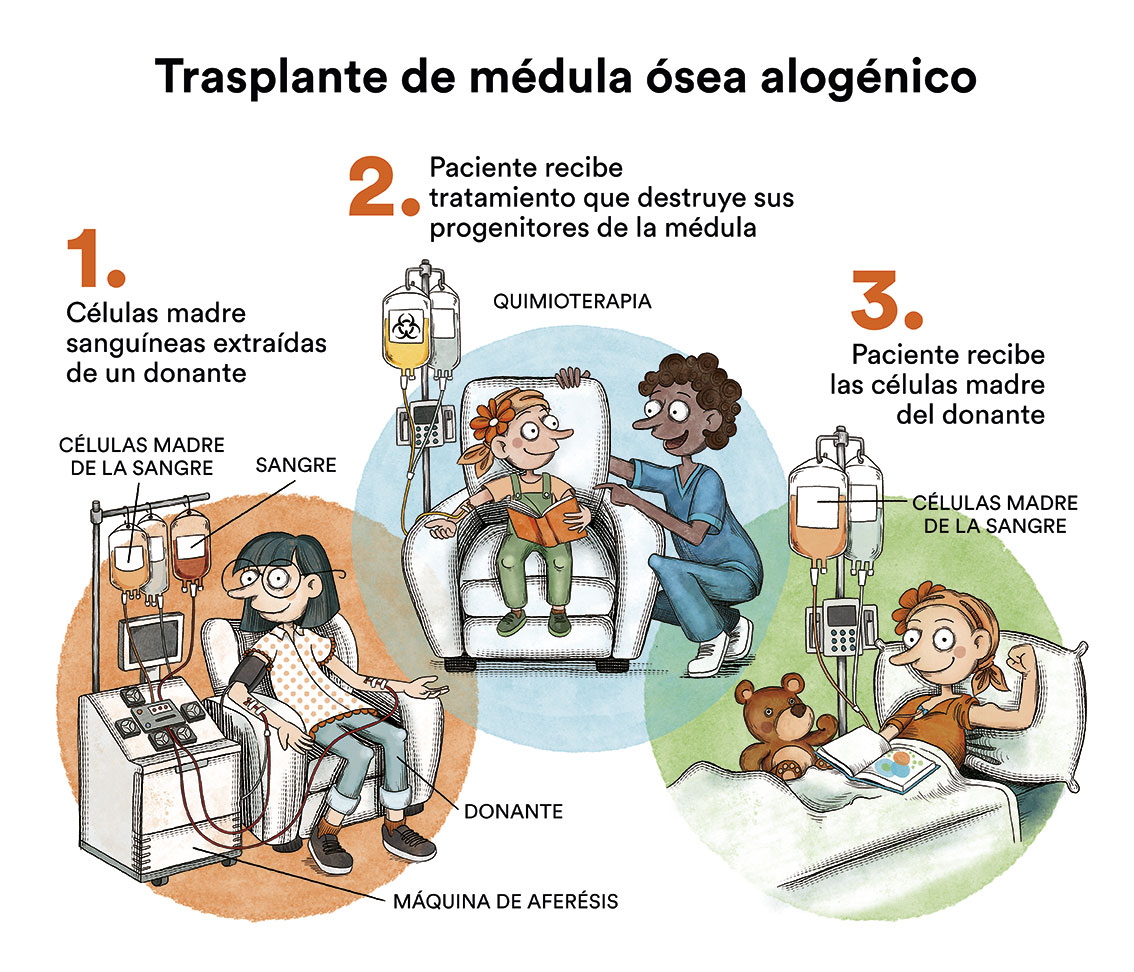
Sin tratamiento, la leucemia mielomonocítica juvenil progresa rápidamente. La quimioterapia (el uso de fármacos especiales para matar células cancerosas) se puede utilizar para controlar de forma temporal la leucemia mielomonocítica juvenil y preparar al paciente para el trasplante, pero no como terapia curativa. Uno de los tratamientos tradicionalmente usado antes de realizar el trasplante de médula es la combinación de los medicamentos quimioterapéuticos busulfán, ciclofosfamida y mefalán. Sin embargo, recientemente se ha aprobado con el mismo fin el uso de azacitidina, que puede ser administrada en pacientes pediátricos a partir de un mes de edad. Los pacientes que consiguen una remisión temporal de la leucemia en estos ciclos de quimioterapia tendrán un mejor pronóstico a largo plazo. Según la Leukemia and Lymphoma Society, el trasplante se recomienda para todos los niños con mutaciones en los genes NF1 y PTPN11. Sin embargo, el enfoque de “espera vigilante” se adopta en los pacientes con mutaciones en el gen CBL y algunos pacientes con mutaciones en NRAS, en los que los que la severidad de la enfermedad menos acusada y en ocasiones puede llegar a resolverse sin intervención. Ver clasificación LMMJ.

Debido a las pocas alternativas de tratamiento existentes para la leucemia mielomonocítica juvenil, existe la posibilidad de que el equipo clínico responsable a cargo del niño o niña pueda proponer la inclusión del mismo en ensayos clínicos con nuevos medicamentos en fase de investigación. Es muy recomendable que el niño o niña sea tratado en un centro de referencia con hematólogos con experiencia en el tratamiento de esta enfermedad.
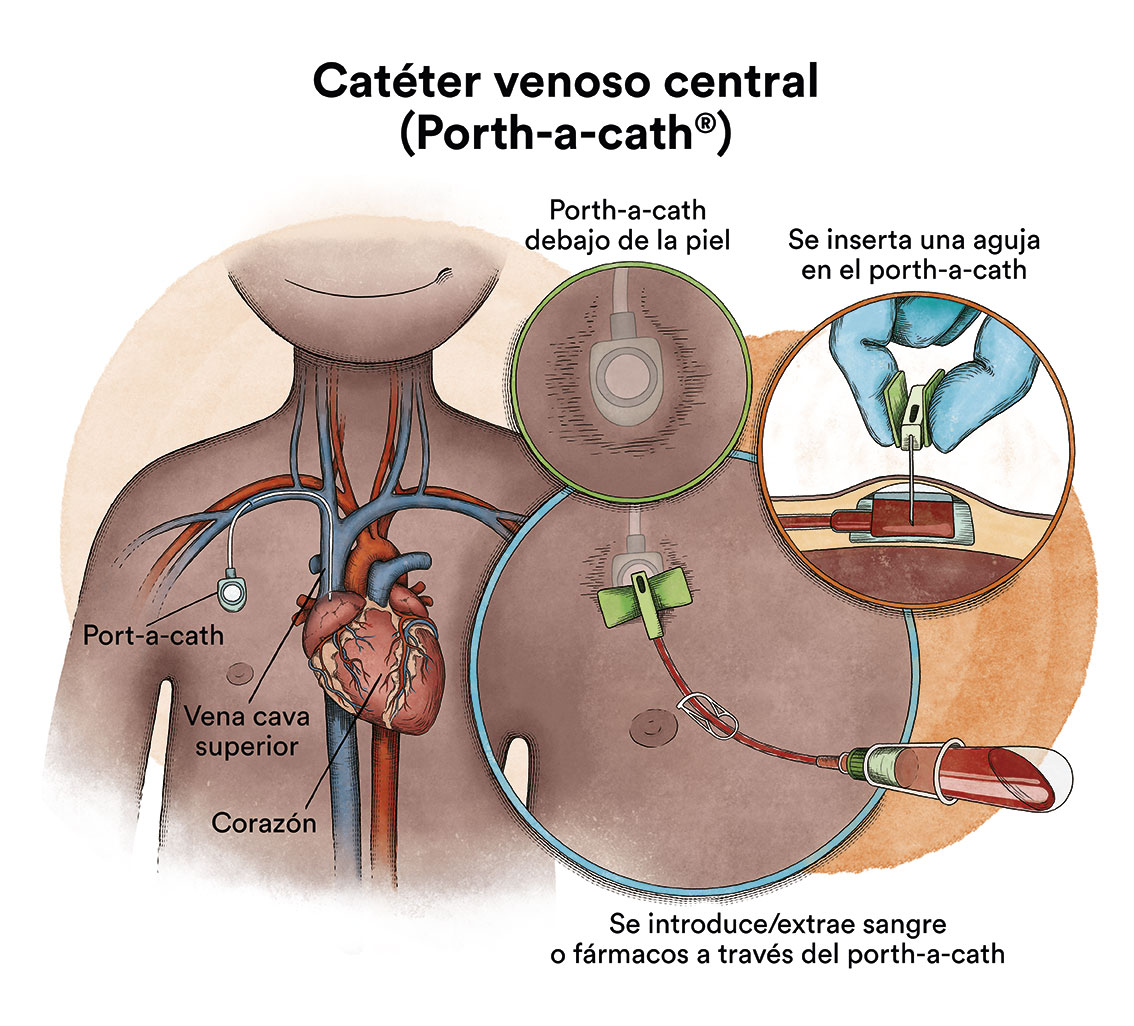
Cuando la quimioterapia se administra por vía intravenosa, para evitar pinchar repetidamente una vena, se utiliza un dispositivo especial llamado catéter. El catéter se introduce en una vena grande y permite tanto la administración de medicamentos, como la extracción de sangre para análisis, evitando de este modo realizar repetidas punciones al pequeño.
Existe un tipo de catéter, llamado port-a-cath, que se une a un reservorio redondo de plástico o metal que queda bajo la piel del tórax. El port-a-cath es muy práctico en niños porque al quedar bajo la piel no permite que el niño o niña se lo arranque, es más difícil que se infecte que otros tipos de catéter y permite que el niño se bañe.
¿Qué probabilidades tienen de curarse los niños con leucemia mielomonocítica juvenil?
Las probabilidades de curación vienen determinadas por las características del paciente, de la enfermedad (alteraciones genéticas/moleculares), el tratamiento que se administre y por la respuesta que se presente a éste.
Alrededor del 50% de los pacientes logra la remisión completa a largo plazo tras el trasplante de médula ósea. Cabe decir que esta terapia no está exenta de complicaciones. Entre el 30 y el 40% de los niños con leucemia mielomonocítica juvenil sometidos a tratamiento y trasplante alogénico recaerá dentro del primer año. En algunas ocasiones, para estos niños se plantea un segundo trasplante de médula ósea.
Nuevos tratamientos contra la leucemia mielomonocítica juvenil
La LMMJ ha representado históricamente un desafío clínico debido principalmente al número limitado de opciones terapéuticas para su tratamiento y al alto riesgo de mortalidad de los niños con las formas más agresivas de la enfermedad. Aunque el trasplante de médula ósea es en la actualidad el único tratamiento curativo, los avances en la investigación de esta enfermedad han permitido identificar nuevas estrategias terapéuticas que se están ya usando en los pacientes o explorando en diferentes ensayos clínicos:
- Agentes hipometilantes: Algunos pacientes de LMMJ presenta altos niveles de metilación en su ADN están asociados con las formas más agresivas de la enfermedad. La metilación es una modificación química que ocurre en el ADN y controla la actividad de los genes. Para contrarrestar esa hipermetilación, recientemente se ha aprobado el uso de azacitidina (Vidaza®) para el tratamiento de los pacientes de LMMJ. Este medicamento entra dentro del grupo de los llamados agentes hipometilantes, capaces de reducir la metilación del ADN. En la actualidad se están estudiando las posibles combinaciones de la Azacitidina con otros fármacos para mejorar los resultados.
- Inhibidores de MEK: La mayoría de los pacientes con leucemia mielomonocítica juvenil presentan mutaciones en genes que producen la hiperactivación de la vía de señalización RAS, que controla la proliferación celular, produciendo un crecimiento descontrolado de las células tumorales. Por este motivo, el bloqueo de la vía RAS con los llamado inhibidores MEK es una de las estrategias terapéuticas que más se está investigando actualmente en para casos de LMMJ en recaída y/o refractarios. Entre estos inhibidores se encuentran los fármacos como el trametinib (Mekinist®).
Seguimiento
Después de completar el tratamiento, el niño seguirá controles periódicos por su médico hematólogo y por otros especialistas en caso necesario. Los controles se realizan para evaluar una posible recaída y para hacer un seguimiento y un tratamiento de las posibles complicaciones a largo plazo. Estos controles se van espaciando progresivamente hasta hacerse una vez al año. Es recomendable realizar un seguimiento como mínimo anual a largo plazo para poder detectar pronto y poder tratar, si aparecieran, las secuelas del tratamiento o de la leucemia.
Enlaces de interés sobre temas médicos relacionados con la leucemia mielomonocítica juvenil
- La leucemia mielomonocítica juvenil. St JudeChildren’s Research Hospital
- La leucemia mielomonocítica crónica y la leucemia mielomonocítica juvenil. Leukeamia & Lymphoma Research
Enlaces de interés sobre otros temas relacionados con la leucemia mielomonocítica juvenil
MATERIALES LEUCEMIA INFANTIL
- Los bebés también tienen leucemia. Fundación Josep Carreras contra la leucemia.
- Leucemia infantil. Los pequeños imparables. Fundación Josep Carrerascontra la leucemia.
- Juego recortable Medulín. Fundación Josep Carreras contra la leucemia.
La Fundación Josep Carreras dispone de un cuento “El bebé forzudo” dirigido a niños o hermanos que padecen leucemia. Está especialmente dirigido a niños hasta los 6 años. Si quieres solicitarlo, puedes enviarnos un correo a imparables@fcarreras.es.
TRASPLANTE DE MÉDULA ÓSEA
- Guía del Trasplante de Médula Ósea. Fundación Josep Carreras contra la leucemia.
- ¿Qué es el HLA y cómo funciona? Fundación Josep Carreras contra la leucemia.
- La Enfermedad Injerto contra Receptor Fundación Josep Carreras contra la leucemia.
- Historia del Trasplante de Médula Ósea. Fundación Josep Carreras contra la leucemia.
- ¿Cómo se realiza la búsqueda de un donante compatible anónimo? Fundación Josep Carreras contra la leucemia.
- Guía de cuidados para niños trasplantados. TransplantCHild.
- El trasplante de células madre: un libro para colorear. Leukeamia and Lymphoma Society.
MANUALES DE APOYO
- ¿Cómo enfrentarse a la leucemia y el linfoma en niños? Leukemia & Lymphoma Society.
- VIVIR APRENDIENDO. Protocolo de actuación para alumnos con cáncer AFANION.
- Guía de apoyo para padres de niños oncológicos ASION.
- Guía para jóvenes y adolescentes con cáncer ASION.
- Alumnado con cáncer. guía para docentes ASION.
- La importancia del comportamiento de los padres cuando un niño tiene cáncer ASION.
- Mi hijo tiene cáncer. ¿Qué hago? FARO.
ALIMENTACIÓN
- ¿Cómo mantener una alimentación saludable durante el tratamiento? Fundación Josep Carreras contra la leucemia.
- “Buen provecho”. Consejos dietéticos durante el tratamiento AFANION.
- ‘Las recetas mágicas de Jabel’. Isabel Rojas Murcia, Carolina Mangas Gallardo.
OTROS
- Información sobre los efectos a largo plazo y tardíos del tratamiento para la leucemia o el linfoma en los niños Leukemia & Lymphoma Society.
- Mi hermano tiene cáncer Fundación Josep Carreras contra la leucemia.
- La escuela en un hospital Fundación Josep Carreras contra la leucemia.
- Educando ilusiones. Guía para la intervención psicoeducativa en niños y adolescentes con cáncer FARO.
- El cáncer en la adolescencia Fundación Josep Carreras contra la leucemia.
- Documental ‘La leucemia y los adolescentes’ Fundación Josep Carreras contra la leucemia.
- Documental ‘Los bebés también tienen leucemia’ Fundación Josep Carreras contra la leucemia.
- 7 formas de ponerse un pañuelo Fundación Josep Carreras contra la leucemia.
- Cuento ‘La princesa Luzie y los caballeros de la quimio’ ASPANAFOA.
- Cuento ‘Vamos a quimioterapia’.
- Cuento ‘Vamos a radioterapia’.
- Cuento ‘Gasparín Super Quimio’ Federación Española de Padres de Niños con Cáncer.
- Vídeo ‘Charlie Brown y la leucemia’.
- Cuento ‘Toby y la máquina voladora’.
- Cuento ‘El hada de las estrellas’ AECC.
- Cuento ‘Lina la pequeña golondrina’ Osakidetza.
Enlaces de interés: entidades locales (recursos y servicios)
ANDALUCÍA ARAGÓN ASTURIAS CASTILLA LA MANCHA CASTILLA LEÓN CATALUÑA COMUNIDAD VALENCIANA EXTREMADURA GALICIA ISLAS BALEARES ISLAS CANARIAS LA RIOJA MADRID MURCIA NAVARRA PAÍS VASCO
Apoyo y ayuda
Te invitamos también a seguirnos a través de nuestras redes sociales principales (Facebook, Twitter e Instagram) en las que, a menudo, compartimos testimonios de superación.
Si resides en España, también puedes ponerte en contacto con nosotros enviándonos un correo electrónico a imparables@fcarreras.es para que te ayudemos a ponerte en contacto con otras familias que han superado esta enfermedad.
* De acuerdo con la Ley 34/2002 de Servicios de la Sociedad de la Información y el Comercio Electrónico (LSSICE), la Fundación Josep Carreras contra la Leucemia informa que toda la información médica disponible en www.fcarreras.org ha sido revisada y acreditada por el Dr. Enric Carreras Pons, Colegiado nº 9438, Barcelona, Doctor en Medicina y Cirugía, Especialista en Medicina Interna, Especialista en Hematología y Hemoterapia y Consultor senior de la Fundación; y por la Dra. Rocío Parody Porras, Colegiada nº 35205, Barcelona, Doctora en Medicina y Cirugía, Especialista en Hematología y Hemoterapia y adscrita a la Dirección médica del Registro de Donantes de Médula Ósea (REDMO) de la Fundación).
Información revisada en noviembre de 2023.


